
Боль – наиболее неприятное и тягостное ощущение, которое испытывает человек. Она может быть самостоятельной проблемой – например, при мигрени и при боли в нижней части спины (БНЧС), – сопровождать травмы и хирургические вмешательства или являться одним из симптомов хронических заболеваний опорно–двигательной системы. Однако во всех случаях боль становится источником страданий и существенно нарушает естественный ритм жизни. Важно отметить, что хроническая боль, независимо от причины своего появления, сама по себе является угрозой для жизни пациента, ведь ее сопровождают такие патологические состояния, как депрессия, тревожность, нарушения сна, расстройства иммунитета, постоянное напряжение сердечно–сосудистой системы. Хорошо известно, что пациенты с хроническими заболеваниями, постоянно испытывающие боль, погибают от сердечно–сосудистых осложнений существенно чаще, чем люди с аналогичной патологией, у которых боль была эффективно устранена. Поэтому попытки «перетерпеть» боль, также как и расхожая рекомендация «научиться жить с болью», представляются, с точки зрения медицинской науки, порочными и вредными [1,2].
Особое значение имеет проблема боли у пациентов с ревматическими болезнями – остеоартрозом (ОА), болью в нижней части спины (БНЧС), ревматоидным артритом, болезнью Бехтерева и др., поскольку это их основное проявление, главная причина обращения за медицинской помощью и первая «мишень» противоревматической терапии.
Не следует думать, что современная терапия заболеваний суставов и позвоночника основывается лишь на применении обезболивающих препаратов. Напротив, главная цель современного противоревматического лечения – остановка прогрессирования заболевания, подавление хронического воспаления и прекращение разрушения суставов. К счастью, благодаря революционным достижениям современной науки в XXI в. ревматологи получили новые, чрезвычайно эффективные лекарства для лечения наиболее тяжелых ревматических заболеваний. Тем не менее обезболивающие препараты продолжают сохранять свое место в комплексной терапии патологии суставов и позвоночника – в качестве вспомогательного, но крайне необходимого средства.
В терапевтической практике наиболее широко используются три группы анальгетиков. Первая из них по сути состоит лишь из одного препарата – ацетаминофена (парацетамол, «простой анальгетик»), выделение которого целесообразно из–за его особой фармакологической позиции. Вторая представлена весьма обширной группой нестероидных противовоспалительных препаратов (НПВП), которых только на российском рынке насчитывается 15: ацеклофенак, диклофенак, ибупрофен, кеторолак, лорноксикам, мелоксикам, метамизол, напроксен, нимесулид, пироксикам, теноксикам, фенилбутазон, флубипрофен, целекоксиб и эторикоксиб. Третья – опиоидные анальгетики, из которых врачам терапевтических специальностей в России реально доступен лишь трамадол (сам по себе или в комбинации с парацетамолом), а также несколько комбинированных препаратов, содержащих малые дозы кодеина в сочетании с НПВП или парацетамолом.
Конечно, этим не исчерпывается весь арсенал обезболивающих средств. Имеются специфические препараты, которые используются для лечения отдельных видов хронической боли. Так, основой терапии тяжелой мигрени является применение триптанов. Для контроля «нейропатической» боли – крайне неприятных ощущений, связанных с поражением центральной и периферической нервной системы, – используются специальные средства, влияющие на возбудимость нейронов и синаптическую передачу (антиконвульсанты, антидепрессанты). В ряде клинических ситуаций хорошо зарекомендовали себя трансдермальные системы, содержащие местные анестетики и наркотические анальгетики. Есть немало препаратов, которые обладают опосредованным обезболивающим потенциалом, или усиливающих действие иных анальгетиков – это миорелаксанты, средства, влияющие на развитие хронической боли (такие как флупиртин), глюкокортикоиды и др.
Однако каждый анальгетик имеет свое место приложения и должен использоваться в зависимости от своих фармакологических свойств и особенностей клинической ситуации. При фармакотерапии любой патологии существует понятие «препарата первой линии» – лекарства (или лекарств), обладающего доказанной эффективностью, хорошей переносимостью и удобством использования, с которого следует начинать лечение. Для лечения умеренно выраженной ноцицептивной боли таким средством, по мнению многих экспертов, является парацетамол.
В развитых странах мира этот препарат – наиболее популярный безрецептурный анальгетик. Ацетаминофен был синтезирован в Германии, причем раньше, чем ацетилсалициловая кислота (АСК) – еще в 1873 г. (Morse M.), – и испытан как жаропонижающее лекарство в 1894 г. (работы Hinsberg O. и Treupel G.). Однако коммерческий препарат парацетамола появился на фармакологическом рынке лишь спустя более чем полвека – в 1950 г., в составе комбинированного обезболивающего средства, зарегистрированного в США. Как самостоятельный препарат он увидел свет через 5 лет (1955), и быстро завоевал симпатию врачей и пациентов по всему миру [3,4].
Популярность парацетамола определяется его превосходной переносимостью и низким риском развития серьезных осложнений. Безопасность пациента – принципиальный критерий выбора анальгетика для первоначальной, эмпирической противоболевой терапии. Ведь назначение обезболивающих средств является терапевтическим действием, которое осуществляется врачом при первом же контакте с пациентом – практически всегда, когда еще не проведено тщательное обследование и не оценены в должной степени возможные риски лекарственных осложнений.
А риск развития осложнений – основной лимитирующий фактор при использовании многих эффективных анальгетиков. В первую очередь, конечно, речь идет о применении самого большого класса обезболивающих средств – НПВП.
Эти лекарства оказывают хорошее терапевтическое действие во всех ситуациях, когда развитие боли связано с повреждением или воспалением ткани. НПВП отличает не вызывающее сомнений эффективность и удобство применения [1,2]. Однако для этого класса симптоматических средств соотношение эффективности и риска осложнений нередко оказывается неблагоприятным, поскольку НПВП могут вызывать серьезные побочные эффекты. В первую очередь это касается опасности развития специфической патологии со стороны верхних отделов желудочно–кишечного тракта (ЖКТ): НПВП–гастропатии, характеризующейся наличием эрозий, язв и «гастроинтестинальных катастроф» – кровотечения и перфорации. Риск этих осложнений у лиц, регулярно принимающих НПВП, возрастает по сравнению с популяцией более чем в 4 раза и составляет примерно 0,5–1 эпизод на 100 пациентов в год. Больные, регулярно получавшие НПВП, погибают от ЖКТ–кровотечений в 2–3 раза чаще, в сравнении с людьми, не принимающими каких–либо препаратов этой группы [5–7].
Не меньшее (а по мнению ряда экспертов, даже большее) значение имеет риск развития осложнений со стороны сердечно–сосудистой системы. Прежде всего речь идет о т.н. кардиоваскулярных катастрофах – инфаркт миокарда, внезапная коронарная смерть, ишемический инсульт. Опасность их появления может существенно возрастать у больных, которые регулярно и в течение длительного времени принимают высокие дозы НПВП. Кардиоваскулярные осложнения связываются с прокоагулянтным действием этих препаратов, которое возникает вследствие нарушения равновесия между синтезом тромбоксана А2 (ЦОГ–1–зависимый процесс) и простациклина (ЦОГ–2–зависимый процесс). По мнению ведущих экспертов, развитие этой патологии весьма характерно для селективных ЦОГ–2–ингибиторов – особого класса НПВП, специально созданного для снижения риска развития гастроинтестинальных осложнений [8–11].
Подавляющее большинство серьезных побочных эффектов, связанных с приемом НПВП (как со стороны ЖКТ, так и сердечно–сосудистой системы), возникают у больных, имеющих т.н. «факторы риска». Важнейшими факторами риска НПВП–гастропатии является наличие язвенного анамнеза, пожилой возраст (старше 65 лет), а также совместный прием НПВП и низких доз АСК. К кардиоваскулярным факторам риска относят прежде всего установленный диагноз ишемической болезни сердца (ИБС) и артериальную гипертензию. Наиболее высок риск у лиц, перенесших инфаркт миокарда или ишемический инсульт [1]. К сожалению, эти факторы очень часто присутствуют у пожилых больных, составляющих основную часть современной популяции, нуждающейся в активной обезболивающей терапии.
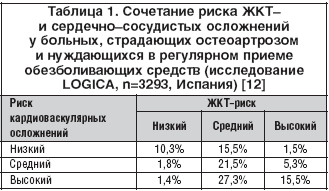
Этот факт прекрасно иллюстрирует масштабное исследование испанских ученых – LOGICA, результаты которого были опубликованы в августе 2010 г. Оно основано на анализе наличия различных факторов риска у больных ОА, не менее 6 мес. регулярно получавших НПВП. Набор материала осуществлялся следующим образом: 374 ревматолога оценили состояние всех больных этим заболеванием, соответствующих критериям отбора, которых им пришлось наблюдать в течение 1 нед. (со 2 по 8 октября 2006 г.). Таким образом, была собрана информация о 3293 пациентах. Критериями высокого риска ЖКТ–осложнений считалось наличие кровотечения в анамнезе, прием антикоагулянтов, а также >3 иных факторов риска; критериями высокого кардиоваскулярного риска – счет по SCORE >5% и/или наличие сахарного диабета 2–го типа, стенокардии или инфаркта миокарда в анамнезе (табл. 1) [12].
Как видно, почти половина больных ОА имела сочетание среднего или высокого риска ЖКТ и кардиоваскулярных осложнений, и лишь у 10,3% пациентов уровень риска был оценен как низкий. Отсюда становятся понятными известные опасения, которые высказывают многие эксперты по поводу широкого использования НПВП у пациентов пожилого возраста.
Очень важно, что при наличии серьезных факторов риска угрожающие жизни побочные эффекты НПВП способны возникать после их использования в течение всего нескольких дней, а иногда даже после однократного перорального приема или внутримышечного введения. Это подтверждает, например, работа американских ученых Blot W. и McLaughlin J., которые оценили влияние приема низких доз НПВП (ОТС–безрецептурных) на развитие ЖКТ–кровотечения. Предметом исследования стали данные 627 пациентов с этим осложнением, занесенных в регистр Американской коллегии гастроэнтерологов (контроль – 590 лиц, соответствующих по полу и возрасту). По результатам проведенного анализа, даже кратковременное использование АСК, ибупрофена и иных представителей группы НПВП увеличивало риск ЖКТ–кровотечения в 2–3 раза. В то же время при использовании парацетамола риск развития этого осложнения не повышался [13].
Опиоидные анальгетики – мощное средство для купирования боли, эффект которых связан с активацией антиноцицептивной системы. Опиоиды весьма популярны в США и Западной Европе, при этом на фармакологическом рынке этих стран присутствует достаточно большое количество различных препаратов этой группы, а процедура их выписки достаточно проста. В нашей стране ситуация иная: практически единственным опиоидным анальгетиком, который мы можем сегодня использовать в терапевтической практике, является трамадол. Конечно, имеются несколько комбинированных анальгетиков, содержащих небольшие дозы кодеина (до 10 мг), однако обезболивающий потенциал этих средств достаточно умеренный – по крайней мере, нет убедительных исследований, доказывающих обратное.
Вероятно, основным достоинством «слабых» опиоидов следует считать низкий риск развития опасных гастроинтестинальных и сердечно–сосудистых осложнений, что выгодно отличает их от НПВП. Однако по своему лечебному потенциалу, вопреки распространенному мнению, они не превосходят НПВП, особенно если речь идет об их длительном применении при хронических заболеваниях опорно–двигательной системы.
В этом плане весьма показательны данные масштабного 12–недельного исследования Delemos B. и сотр., результаты которого было опубликованы в 2010 г. Исследуемую группу составили 1001 пациент с ОА коленного или тазобедренного суставов, испытывающий выраженную боль: более 40 мм по ВАШ. Больные были включены в пять групп в соответствии с назначенной терапией: в трех из них был назначен трамадол 100, 200 и 300 мг/сут., а еще в двух – НПВП (целекоксиб 200 мг в качестве оценки чувствительности модели) и плацебо. Эффективность терапии оценивалась по динамике индекса WOMAC (шкала боли и функциональных нарушений) и общей оценке самочувствия. Согласно полученным данным, только использование наибольшей дозы трамадола (300 мг) приводило к значимому улучшению общего самочувствия пациентов. Но достоверного влияния на показатели WOMAC при использовании этого препарата отмечено не было. При этом препарат из группы НПВП оказался стабильно эффективным – на фоне его приема улучшение состояния заметно отличалось от действия плацебо [14].
Нужно принять во внимание, что даже использование «сильных» наркотических опиоидов не решает полностью проблему лечения хронической боли у неонкологических пациентов. Хорошим примером умеренной эффективности этого класса анальгетиков при ревматологической патологии можно считать масштабное европейское исследование Kalso Е. и сотр. В данную работу было вовлечено 680 больных с хронической БНЧС (61% женщин, средний возраст 52 года, средняя длительность болезни 12,5 года). Согласно плану исследования, пациенты в течение 13 мес. получали перорально морфин замедленного высвобождения или трансдермальную систему (ТДС) с фентанилом, причем доза препарата подбиралась индивидуально методом титрования, в зависимости от выраженности боли и переносимости терапии. Важно отметить, что в исследование не включались больные, уже регулярно получавшие до этого «сильные» опиоиды. Выраженность боли оценивалась по ВАШ в покое, при движении, днем и ночью, и фиксировалась в дневнике; анализ терапевтического действия изучаемых препаратов проводился в ходе работы постоянно. Оказалось, что существенное улучшение состояния (на 30% и более в сравнении с исходным уровнем) было достигнуто лишь у половины пациентов: 55% на морфине и 54% на трансдермальной форме (ТДФ). У 4 и 5% лечение было прервано из–за неэффективности терапии, а у 31 и 37% – из–за различных побочных эффектов [15].
В последние годы были опубликованы данные двух мета–анализов, оценивающих возможность успешного использования трамадола (всего 11 рандомизированных контролируемых испытаний (РКИ), n=1019) и других опиоидов (всего 10 РКИ, n=2268) у пациентов, страдающих ОА. По мнению авторов, опиоиды, без сомнения, эффективны при этом заболевании, однако их преимущество в сравнении с другими анальгетиками относительно невелико, а различные побочные эффекты они вызывают заметно чаще. Поэтому рутинно использовать трамадол и опиоиды при неонкологических заболеваниях не следует, особенно если речь идет о длительной терапии [16,17]. Опиоиды следует рассматривать в качестве средства «второй линии» при непереносимости или неэффективности НПВП, а также в качестве альтернативной или добавочной терапии при хронической боли.
Становится очевидным, что НПВП и опиоиды, хотя и являются эффективными анальгетиками, имеют при этом явные недостатки. Применение НПВП связано с риском развития опасных ЖКТ–осложнений и кардиоваскулярных катастроф. Опиоиды в этом плане гораздо безопаснее, однако их субъективная переносимость оставляет желать лучшего. При этом в нашей стране имеются серьезные законодательные ограничения, затрудняющие применение этих препаратов в терапевтической практике. Поэтому для нас столь интересен парацетамол – безрецептурное лекарство с отличной переносимостью и низким риском развития опасных осложнений.
Эффективность парацетамола
Фармакологическое действие парацетамола отличается от НПВП и опиоидов. Он обладает способностью подавлять синтез провоспалительных простагландинов, блокируя фермент ЦОГ, но в отличие от НПВП (их действие связано с блокадой ЦОГ–2–индуцируемого фермента, проявляющего свою активность в области тканевого повреждения или воспаления), парацетамол влияет на другую его изоформу – ЦОГ–3, определяющуюся в центральной нервной системе. Именно с центральным действием этого препарата связаны его анальгетические и антипиретические эффекты. Парацетамол проявляет также свойства слабого селективного ЦОГ–2 ингибитора, но этот эффект недостаточен для развития значимого противовоспалительного действия непосредственно в очагах тканевого повреждения. Помимо этого, имеются данные об активирующем воздействии парацетамола на антиноцицептивную систему за счет влияния на нисходящие серотонинэргические пути и каннабиодные рецепторы [18,19].
Данные клинических исследований четко подтверждают возможность успешного использования парацетамола как для купирования острой боли, так и при терапии хронических болевых синдромов.
Так, имеются серьезные доказательства значимого терапевтического действия этого препарата в послеоперационном периоде. Это показывают, в частности, данные последнего мета–анализа эффективности парацетамола, н–НПВП и с–НПВП (всего 60 плацебо–контролируемых РКИ), причем главным критерием действия препаратов было снижение потребности в опиоидах (морфин). «Простой анальгетик» достоверно снижал потребность в морфине: если на фоне приема плацебо его в среднем требовалось 37,4 мг/сут., то при использовании парацетамола – на 6,34 мг меньше. Правда, этот эффект был ниже, чем при назначении НПВП – 10,2 и 10,9 мг соответственно [20].
Результаты мета–анализа Cochrane (2008) также показывают вполне приемлемый результат использования парацетамола при острой послеоперационной боли. Это исследование включало данные 51 РКИ (n=5762). Было показано, что парацетамол при однократном приеме в дозе 500 мг и выше, достоверно превосходит плацебо, обеспечивая четкое уменьшение боли у 50% пациентов примерно на 4–6 ч. В зависимости от дозы индекс NNT («number–needed–to–treat» – число больных, которых необходимо пролечить для получения заданного отличия от плацебо) при однократном применении парацетамола составлял от 3,5 до 4,6. Это неплохой результат – ведь при этом побочные эффекты возникали очень редко, и они в подавляющем большинстве случаев были легкими [21].
Большое число работ оценивает терапевтические возможности парацетамола при стоматологической боли [22]. Dodson T. и сотр. провели мета–анализ 21 плацебо–контролируемого РКИ (всего 2048 пациентов), в которых обезболивающее действие парацетамола оценивалось у больных, перенесших удаление третьего моляра. Суммарно парацетамол был достоверно эффективнее, обеспечивая значительно более выраженное облегчение боли на срок до 6 ч после однократного приема. Индекс NNT составил около 3, при этом отмечалась достаточно четкая зависимость от дозы – наиболее эффективным оказалось использование парацетамола в дозе равной или более 1000 мг. Число побочных эффектов на парацетамоле составило 19%, что практически не отличалось от плацебо – 16% [23].
Парацетамол благодаря удачному сочетанию безопасности и эффективности является препаратом выбора для начала эмпирической терапии умеренно выраженной головной боли различного происхождения, в т.ч. у подростков и детей [24]. В марте 2010 г. были представлены данные крупного многоцентрового исследования, в котором сравнивалась эффективность однократного приема 1000 мг парацетамола и плацебо у 346 пациентов с острым приступом мигрени. Через два часа после приема 52,0% пациентов, получивших парацетамол, отметили существенное облегчение или исчезновение головной боли; это было достоверно больше в сравнении с группой плацебо – 32,0% (р<0,001). Прием парацетамола также эффективно купировал симптомы, ассоциированные с мигренью – тошноту, фото– и фонофобию [25]. Недавнее масштабное исследование, проведенное в Германии, позволяет сопоставить эффективность парацетамола и популярных «безрецептурных» НПВП. Его целью было изучение действия комбинированного препарата, содержащего парацетамол, АСК и кофеин, для купирования острого эпизода головной боли. Исследуемую группу составили 1734 амбулаторных пациента, разделенных на 4 группы: получавшие комбинированный анальгетик, парацетамол и АСК по отдельности или ибупрофен. Через 2 ч после приема, уменьшение боли (в мм по 100–мм шкале ВАШ) составило соответственно 43,0; 38,2; 38,1; и 37,7 мм. Таким образом, парацетамол сам по себе несколько уступал комбинированному средству, но был не менее эффективен, чем ибупрофен и АСК [26]. Важной областью применения парацетамола является купирование гипертермии и лихорадочного состояния при острых респираторных вирусных инфекциях (ОРВИ). В качестве антипиретика он столь же эффективен, как АСК, что наглядно продемонстрировали данные крупного многоцентрового российско–украинского исследования. В ходе этой работы 392 больных ОРВИ с высокой лихорадкой (температуры >38,5°С) получали АСК 500 или 1000 мг, парацетамол 500 или 1000 мг или плацебо. Во всех группах больных, получавших активное лечение, отмечалось выраженное жаропонижающее действие – так, среднее снижение температуры (в градусах Цельсия) составило 1,32 и 1,25; 1,67 и 1,71, и 0,63 соответственно, т.е. оказалось несколько большим при использовании парацетамола [27].
Парацетамол за счет своей превосходной переносимости является общепризнанным препаратом «первой линии» для купирования боли при наиболее распространенном хроническом ревматологическом заболевании – остеоартрозе. Использование анальгетиков при этой патологии, как было отмечено выше, имеет принципиальное значение, ведь основное клиническое проявление ОА – хронические суставные боли. Объективной реальностью является тот факт, что современная патогенетическая терапия этого заболевания («пероральные хондропротекторы», препараты гиалуроновой кислоты) не позволяет полностью отказаться от использования симптоматических обезболивающих средств. Именно поэтому пациенты, страдающие ОА, являются основными потребителями анальгетических препаратов в современном мире. Но, как было убедительно показано в приведенном нами исследовании LOGICA, сложность подбора рациональной обезболивающей терапии у больных ОА заключается в наличии выраженной сопутствующей патологии, прежде всего со стороны сердечно–сосудистой системы и ЖКТ [28,29].
Поэтому назначение парацетамола четко определено в качестве первого терапевтического шага при лечении ОА крупных суставов и кистей в рекомендациях европейской (EULAR) и американской (ACR) ассоциаций ревматологов [30–32].
Очень показательны результаты работы ученых из Франции, которые оценили выполнение рекомендаций EULAR по лечению ОА в своей стране. Они анкетировали 967 врачей общей практики, каждому из которых было предложено описать лечение трех своих пациентов с ОА крупных суставов. Оказалось, что почти все терапевты, в соответствии с рекомендациями, уделяли должное внимание образованию больных и немедикаментозным методам лечения. В отношении фармакотерапии первыми назначениями оказались парацетамол (60,6% анкетированных) или НПВП, обычно в сочетании с парацетамолом (30,2% анкетированных) [33].
Российские врачи, к сожалению, не так часто назначают парацетамол пациентам с ревматическими заболеваниями. Сегодня в нашей стране наиболее популярным средством для купирования боли у этой категории больных являются НПВП. Причиной этого, на наш взгляд, является недостаток информации о терапевтических возможностях парацетамола. Многие российские врачи считают парацетамол достаточно слабым анальгетиком, который не обеспечивает необходимого контроля боли при серьезной патологии суставов.
Это совсем не так. Хотя серия масштабных исследований – PACES–a, PACES–b, VACT, IPSO – подтверждает преимущества НПВП при ОА [34–36], тем не менее у существенной части пациентов с этим заболеванием парацетамол обеспечивает вполне приемлемый контроль суставной боли. Это весьма наглядно демонстрирует классическое исследование Williams H. и сотр., в ходе которого 178 больных ОА в течение 2 лет (!) получали парацетамол (до 4 г/сут.), или напроксен (до 1 г/сут.). Хотя по ряду показателей напроксен демонстрировал лучшие результаты, тем не менее число отмен из–за неэффективности на фоне приема НПВП было не намного меньше: 16% vs 22% (различие недостоверно). При этом число отмен терапии из–за побочных эффектов, наоборот, оказалось меньшим при использовании парацетамола: 18% vs 23%. Кстати, в этом исследовании было показано отсутствие какого–либо преимущества длительного применения НПВП в отношении развития ОА. Рентгенологический контроль не выявил замедления темпов дегенеративных процессов в пораженных суставах у больных, получавших напроксен, в сравнении с больными, получавшими парацетамол [37].
Терапевтические достоинства парацетамола четко показывает исследование Temple A. и сотр. Они оценивали сравнительную эффективность и безопасность парацетамола 4 г/сут. или напроксена 750 мг/сут. у 571 больного ОА (ср. возраст 59,3±8,6 лет) в течение 6 и 12 мес. Успех терапии, который определяли с использованием индекса WOMAC, не доказал значимого преимущества напроксена; одинаковым оказалось соотношение больных, закончивших исследование, а также приверженность пациентов назначенной терапии. Парацетамол при этом переносился суммарно лучше. Так, на фоне приема напроксена чаще отмечались отеки (9,9% vs 3,1%), нарушение стула (3,9% vs 1,0%), а у одной больной развилось опасное ЖКТ–кровотечение [38].
В 2006 г. были опубликованы данные мета–анализа Cochrane, в котором проводилось сравнение эффективности парацетамола с плацебо или НПВП при ОА (всего 15 РКИ, n=5986). Согласно полученным результатам, парацетамол достоверно превосходил плацебо в отношении анальгетического действия и улучшения функции пораженных суставов. Число побочных эффектов на фоне приема парацетамола и плацебо не различалось. Парацетамол уступал по своему обезболивающему действию НПВП, однако показывал значительно лучшую переносимость. При этом он значительно реже вызывал серьезные гастроэнтерологические осложнения [39].
Не следует рассматривать парацетамол как «конкурент» НПВП или опиоидов. Наиболее рационально воспринимать этот препарат в качестве необходимой составной части комплексной противоболевой терапии. Ведь механизм действия парацетамола отличается от других анальгетиков, а значит, их комбинированное использование в сравнении с монотерапией должно обеспечивать больший терапевтический успех.
Это доказывает успешный опыт применения комбинации парацетамола с опиоидными анальгетиками. Toms L. и сотр. провели мета–анализ 26 РКИ (всего 2295 больных), в которых оценивалась эффективность препаратов на основе парацетамола и кодеина при острой послеоперационной боли. Результаты исследования показали высокий терапевтический потенциал подобного сочетания: при его использовании, значимое уменьшение выраженной боли в среднем достигается у 50% больных; плацебо обеспечивает аналогичный эффект лишь у 20%. При этом определялась несомненная зависимость между дозой парацетамола (при стабильной дозе опиоида) и достигнутым улучшением: индекс NNT для 800–1000 мг составил 2,2 (1,8–2,9), для 600–650 мг – 3,9 (2,9–4,5) [40].
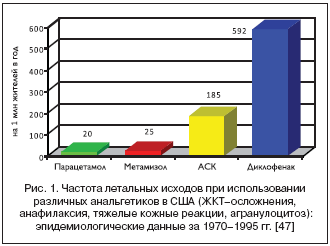
Не менее удачной оказалась комбинация парацетамола и трамадола, что подтверждает мета–анализ 7 РКИ, в которых ее эффективность оценивалась при стоматологических, гинекологических и ортопедических операциях [41]. Так, в работе Fricke J. и сотр. 456 пациентов, испытывавщих боль после удаления зуба, получали по 2 таблетки, содержащих комбинацию трамадол 37,5 мг + 325 мг парацетамола, только трамадол 50 мг, или плацебо. Комбинированная терапия была достоверно эффективна по всем оцениваемым параметрам – так, общее облегчение боли (по шкале 0–24) через 5 ч после манипуляции в среднем составило 7,4; 2,5 и 1,5 соответственно (р<0,001) [42]. Аналогично ситуации с опиоидами, совместное применение парацетамола и НПВП четко усиливает обезболивающее действие последних. Доказательством этого является работа Ong C. и сотр., представленная в 2010 г. Ученые провели мета–анализ 21 РКИ (n=1909), в которых оценивалось обезболивающее действия различных НПВП – в виде монотерапии и в комбинации с парацетамолом. По итогам исследования авторы делают заключение о несомненной целесообразности такой комбинации, ведь уменьшение интенсивности боли и снижение потребности в дополнительных анальгетиках при совместном применении этих лекарств оказались почти на 30% больше, чем при монотерапии парацетамолом или НПВП [43]. Это положение хорошо иллюстрирует исследование Akural E. и сотр. В этой работе 76 пациентов с выраженной болью после удаления третьего моляра получали парацетамол 1000 мг, кетопрофен 100 мг, комбинацию этих препаратов или плацебо. Значимое облегчение боли было достигнуто во всех лечебных группах (в отличие от плацебо), однако эффект был значимо выше при сочетанном использовании парацетамола и НПВП [44]. Следует отметить, что комбинированное использование парацетамола и НПВП при лечении хронической боли, в частности при ОА, представляет большой интерес для клиницистов. Такая терапия позволяет не только усилить лечебное действие, но также снизить дозу НПВП. Это очень важно с точки зрения снижения риска лекарственных осложнений, ведь есть прямая зависимость между дозой НПВП и частотой развития серьезных побочных эффектов [45]. Использование парацетамола и риск развития серьезных побочных эффектов Парацетамол традиционно считается весьма безопасным средством, и этому есть достоверное подтверждение [46]. Так, одним из важных достоинств парацетамола при его использовании для послеоперационного обезболивания является низкий риск развития кровотечений из области хирургической раны, а также ЖКТ–кровотечений. В цитированной выше работе McDaid C. и сотр. было показано, что на фоне использования плацебо, парацетамола и селективных ЦОГ–2–ингибиторов вероятность развития подобных осложнений не возрастала. В то же время использование «традиционных» НПВП отчетливо увеличивало риск: частота послеоперационных кровотечений составляла 2,4%, а ЖКТ–кровотечений – 2,3% (в группах плацебо – 0,4 и 0% соответственно) [20]. Весьма ценным подтверждением репутации парацетамола может считаться исследование американских ученых Andrade S. и сотр., опубликованное в 1998 г. Эта работа представляет собой анализ данных всех эпидемиологических исследований, проведенных в США за период 1970–1995 гг., в которых определялась частота гибели пациентов от лекарственных осложнений, связанных с приемом анальгетиков. В рассмотрение брались случаи летальных исходов, возникших вследствие ЖКТ–кровотечения и перфорации, анафилаксии, тяжелых поражений кожи и слизистых, а также гематологических проблем (агранулоцитоз). На 1 млн жителей США от подобных осложнений погибали 185 потребителей АСК, 592 – диклофенака, 25 – метамизола и лишь 20 – парацетамола (рис. 1). При этом, видя относительно низкий риск гибели пациентов, принимавших метамизол, следует принять в рассмотрение, что использование этого препарата было прекращено в США с 1978 г. из–за высокого риска гематологических осложнений. Поэтому данные о его «безопасности» связаны прежде всего с ограниченным материалом [47]. Низкий риск ЖКТ–осложнений (кровотечения, перфорации, язвы) при использовании этого препарата демонстрирует исследование Singh G. (2000). В этой работе была использована база данных ARAMIS, в которой находилась информация о 4164 больных ревматоидным артритом, получавших различные «безрецептурные» НПВП (ОТС) или парацетамол. Согласно полученным данным, частота ЖКТ–осложнений на фоне приема парацетамола не отличалась от лиц, не получавших какие–либо анальгетики: 0,16 и 0,17 эпизодов на 100 пациенто–лет. При этом она оказалась более чем в 3 раза ниже, в сравнении с ОТС НПВП (напроксен, АСК, ибупрофен) – 0,58 на 100 пациентов/лет [48]. Lanza F. и сотр. оценили влияние 7–дневного приема низкой (безрецептурной) дозы кетопрофена – 75 мг/сут., парацетамола – 4 г/сут. и плацебо на состояние слизистой желудка и 12–перстной кишки у 24 здоровых добровольцев. Согласно результатам эндоскопического исследования, которое проводилось до и в конце приема изучаемых лекарств, влияние максимальной дозы парацетамола не отличалось от плацебо. В то же время кетопрофен достоверно чаще вызывал повреждение слизистой, включая развитие язв желудка у 2 добровольцев [49]. Низкий риск ЖКТ–осложнений при использовании парацетамола показывает популяционное исследование (по типу «случай–контроль»), проведенные испанскими учеными Lanas A. и сотр. Авторы провели анализ причин ЖКТ–кровотечения у 2774 пациентов, при этом контроль составили 5532 лиц, соответствующих по полу и возрасту. Было показано, что использование НПВП суммарно ассоциировался с 5–кратным повышением риска кровотечения (ОР 5,3; 4,5–6,2). Чуть меньшая опасность была связана с приемом низких доз АСК – 3,7 (3,0–4,5). Даже применение селективных НПВП сопровождалось умеренным повышением риска кровотечений (относительный риск (ОР) 1,5; 0,9–2,4). Только парацетамол не оказывал подобного негативного влияния (ОР 0,9; 0,7–1,1) [50]. Аналогичные результаты были показаны в эпидемиологическом исследовании Rahme E. и сотр., которые провели оценку частоты ЖКТ–кровотечений среди 644 183 пожилых жителей провинции Квебек (Канада), получавших парацетамол или традиционные НПВП. Согласно полученным результатам, риск этого осложнения у пациентов, не получавших гастропротекторов, при использовании высоких доз парацетамола (>3 г/сут.) был заметно ниже, чем на фоне традиционных НПВП: ОР составил 1,2 (1,03–1,40) и 1,63 (1,44–1,85) соответственно. Правда, комбинация НПВП и парацетамола ассоциировалась с серьезным повышением частоты кровотечений – ОР 2,55 (1,98–3,28) [51].
Правда, в масштабном эпидемиологическом исследовании, проведенном в Великобритании, на фоне использования высоких доз парацетамола было отмечено существенное повышение риска развития опасных ЖКТ–осложнений. Авторы изучали частоту развития этой патологии в когорте из 958 397 жителей. За период с 1993 по 1998 г. ЖКТ–кровотечение или перфорация язвы развились у 2105 лиц. В качестве контроля авторы использовали 11 500 представителей той же когорты соответствующего возраста и пола. По сравнению с людьми, не получавшими анальгетиков, парацетамол в дозе до 2 г/сут. не вызывал нарастания частоты ЖКТ–осложнений. Но на фоне использования более высоких доз риск повышался весьма существенно – ОР 3,6 (2,6–5,1). Этот показатель был близок к соответствующим значениям для низких/средних доз НПВП – 2,4 (1,9–3,1), и высоких доз НПВП – 4,9 (4,1–5,8) [52].
После печальной памяти «кризиса коксибов» проблема кардиоваскулярного риска, связанного с использованием НПВП, остается областью пристального интереса медицинской общественности. Парацетамол в этом отношении имеет лучшую репутацию – согласно мнению большинства ведущих экспертов, риск развития сердечно–сосудистых осложнений при использовании парацетамола достаточно низок [1,2].
Экспериментальные данные не показывают какого–либо значимого влияния парацетамола на агрегацию тромбоцитов у добровольцев, а также на прогрессирование ишемической болезни сердца и развитие инфаркта миокарда у лабораторных животных [53–55].
Следует отметить, однако, что несколько крупных эпидемиологических исследований показывают определенное повышение риска кардиоваскулярных катастроф на фоне длительного применения высоких доз парацетамола. Правда, оно не столь существенно, чем на фоне приема НПВП. Chan A. и сотр. провели анализ зависимости между приемом различных анальгетиков в когорте 70 971 женщин. За период наблюдения (около 12 лет) был отмечен 2041 эпизод инфаркта миокарда, ишемического инсульта и внезапной коронарной смерти. Сам по себе факт приема обезболивающих препаратов не ассоциировался с развитием этой патологии. Но их частый прием – 22 и более дозы в месяц – повышал риск кардиоваскулярных катастроф: ОР 1,44 (1,27–1,65) для НПВП и 1,35 (1,14–1,59) для парацетамола. Аналогично влиял и факт приема большого количества анальгетиков – более 15 доз в неделю. Риск сердечнососудистых осложнений составил, 1,86 (1,27–2,73) и 1,68 (1,10–2,58) соответственно [56].
Влияние парацетамола на развитие артериальной гипертензии было прослежено в 2 известных эпидемиологических исследованиях, проведенных в США и касающихся соответственно женской и мужской части популяции этой страны. В первой из этих работ авторы проследили когорту, включавшую 51 630 женщин 44–69 лет (средний срок наблюдения 8 лет). Частый прием парацетамола (< 22 дней в месяц) ассоциировался с умеренным риском развития артериальной гипертензии: ОР 1,20 (1,08–1,33). Этот риск был равен аналогичному риску для столь же регулярного приема АСК – 1,21 (1,13–1,30) и оказался несколько меньше, чем при использовании иных НПВП – 1,35 (1,25–1,46) [57]. Второе исследование было посвящено мужчинам; изучаемую когорту составили 16 031 представитель сильного пола (наблюдение до 4 лет). Как и у женщин, регулярный прием парацетамола ассоциировался с некоторым повышением риска развития артериальной гипертензии – ОР 1,34 (1,00–1,79). Для АСК и других НПВП этот риск составил 1,26 (1,14–1,40) и 1,38 (1,09–1,75) соответственно [58]. Необходимо отметить, что популяционные работы подобного рода имеют существенное ограничение. В них не оценивается влияние на развитие артериальной гипертензии и кардиоваскулярных катастроф заболевания, ставшего причиной регулярного приема анальгетиков. Это в основном, конечно, хронические проблемы с суставами и позвоночником, а сегодня хорошо известно, что ревматические заболевания сами по себе существенно повышают риск развития и прогрессирования патологии сердечно–сосудистой системы. Однако неоспорим тот факт, что в длительных клинических исследованиях на фоне приема парацетамола не было отмечено повышения риска кардиоваскулярных осложнений. Так, в российском 12–месячном исследовании ДИНАМО изучалась сравнительная эффективность и безопасность нимесулида 200–100 мг/сут. и парацетамола 3 г/сут. у 30 больных ОА, имеющих повышенный кардиоваскулярный риск. В ходе исследования проводился тщательный мониторинг состояния сердечно–сосудистой системы, включающий повторное холтеровское мониторование и регулярный осмотр специалиста–кардиолога. И тут исследователей ожидал неприятный сюрприз: на фоне приема НПВП у 4 пациенток отмечалась четкая отрицательная динамика, указывающая на развитие или прогрессирование ишемической болезни сердца; подобных осложнений у пациентов, получавших парацетамол, отмечено не было [59]. В 2007 г. были опубликованы рекомендации по контролю мышечно–скелетной боли, созданные ассоциацией американских кардиологов (American Heart Association – AHA). Их целью являлось стремление снизить до минимума опасность сердечно–сосудистых осложнений при использовании анальгетиков. Поэтому препаратом выбора они определили парацетамол (рис. 2). При его неэффективности следует использовать АСК, трамадол, даже наркотические анальгетики, затем салицилаты, а вопрос о назначение любых НПВП возможно рассмотреть лишь при неэффективности этих назначений [60]. Многие эксперты отмечают спорность этих рекомендаций. Однако необходимо отметить важный факт, что такая влиятельная организация, как АНА, считает парацетамол гораздо безопаснее в плане кардиоваскулярных осложнений, чем любые другие анальгетики. Низкий риск кардиоваскулярных осложнений позволяет применять парацетамол даже в тех ситуациях, когда их опасность представляется предельной. Так, имеется опыт успешного использования сверхвысоких доз парацетамола (6 г/сут.) для купирования злокачественной гипертермии у пациентов, перенесших инсульт. Эта область терапевтического применения парацетамола была предметом изучения в двух многоцентровых исследованиях – PISA (n=75) и PAIS (n=1400), и в обоих парацетамол показывал достоверно большую эффективность, чем плацебо. В масштабном исследовании PAIS также была отмечена четкая тенденция к большей выживаемости больных (вероятность благоприятного исхода 1,4 в сравнении с плацебо). При этом число осложнений со стороны сердечно–сосудистой системы у больных, получавших высокие дозы парацетамола, не отличалось от больных, входивших в группу пассивного контроля [61,62]. Большой интерес представляет работа британских ученых, посвященная оценке материальных затрат на использование различных НПВП при ОА. Этот анализ основан на результатах серии крупных РКИ и наблюдательных исследований, проводившихся в последние годы. Среди прочего авторы провели оценку частоты осложнений – со стороны как ЖКТ, так и сердечно–сосудистой системы, на фоне приема различных НПВП и парацетамола. Так, согласно их расчетам, при использовании парацетамола 3 г/сут. частота клинически выраженных язв ЖКТ, ЖКТ–кровотечений и инфаркта миокарда составляет соответственно 14, 7 и 26 на 10 000 пациенто–лет, что не отличается от аналогичных цифр для лиц, не получающих какой–либо обезболивающей терапии. В тоже время для ибупрофена 1200 мг/сут. и целекоксиба 200 мг/сут. частота подобных осложнений составляет 80 и 38, 30 и 20, 61 и 59 эпизодов на 10 000 пациенто–лет [63]. Парацетамол и риск развития патологии со стороны печени и почек Не вызывает сомнения, что намеренное, с целью суицида, или случайное применение сверхвысоких доз парацетамола неизбежно вызывает тяжелое поражение печени, вплоть до развития фульминантной печеночной недостаточности. Опасные гепатотоксические реакции могут возникать в случае использовании парацетамола в дозе более 10 г/сут. – т.е. превышающей максимально допустимую суточную в 2,5 раза. Токсическая доза парацетамола для детей младше 6 лет при однократном приеме составляет 200 мг/кг. Для взрослого человека потенциально летальной является доза парацетамола, превышающая 20 г/сут. В этом случае спасти жизнь может лишь немедленная госпитализация в реанимационное отделение, применение специального антидота – N–ацетилцистеина или трансплантация печени. Риск развития отравления парацетамолом повышает алкоголизм, сопутствующий прием гепатотоксических препаратов, наличие исходной патологии печени, а также голодание [64–66]. Тяжелая патология почек, сопровождающаяся острой почечной недостаточностью, возникает существенно реже – примерно у 1–2% лиц с отравлением парацетамолом. Это может быть самостоятельная проблема, причиной которой является массивный тубулярный некроз. Однако ряд экспертов считают, что нефропатия при интоксикации парацетамолом носит вторичный характер и в большей степени определяется гепаторенальным синдромом, связанным с развитием печеночной недостаточности [67,68]. Тяжелые гепатотоксические реакции, связанные с приемом парацетамола – серьезная медицинская и социальная проблема для западных стран, где этот препарат является повсеместно используемым безрецептурным обезболивающим средством. Однако нужно помнить, что такие осложнения практически всегда возникают только в случае его значительной передозировки. «Правильное» терапевтическое применение парацетамола не повышает опасность развития клинически выраженной патологии печени, что было показано, в частности, в работе Kuffner E. и сотр. Ученые провели мета–анализ 9 РКИ, в которых оценивалась безопасность приема парацетамола в дозе 2–4 г/сут. в течение от 4 нед. до 12 мес. (n=1530). У подавляющего большинства больных в период лечения не было отрицательной динамики биохимических показателей. Какое–либо повышение трансаминаз относительно исходных значений отмечалось у 17,4%, однако лишь у 4,2% оно превышало нормальные показатели более чем в 1,5 раза. При этом ни у кого не было повышения АЛТ более чем в 10 раз; не было также повышения билирубина. Необходимо отметить, что практически у всех больных (93,5%), имевших значимое повышение АЛТ, биохимические показатели нормализовались сами по себе на фоне продолжения приема парацетамола. При этом никто из пациентов, длительно получавших парацетамол, не развил клинически выраженный лекарственный гепатит или острую печеночную недостаточность [69]. Распространенным мифом является наличие «особой опасности» при использовании парацетамола у лиц, страдающих заболеваниями печени или при злоупотреблении алкоголем. Нужно отметить, что данный вопрос достаточно хорошо изучен. В частности, решению вопроса о возможности использования парацетамола у подобного контингента посвящен систематический обзор, представленный Dart R. и сотр. Ученые оценивали ряд исследований различного типа. Их работа включает анализ данных двух хорошо организованных слепых РКИ, в которых 60 и 200 пациентов, злоупотребляющих алкоголем, получали парацетамол в дозе от 1 до 4 г/сут. в течение не менее 2 сут. В обоих исследованиях достоверной динамики трансаминаз и протромбинового индекса отмечено не было; не было и эпизодов клинически выраженной патологии печени. Аналогичные результаты были получены в ходе 5 небольших по объему открытых исследований (от 5 до 26 больных), в которых парацетамол 1,5–4 г/сут. назначался сроком до 5 дней лицам с разнообразной патологией печени (включая цирроз). Практически все больные переносили этот препарат хорошо или удовлетворительно, причем у большинства не было отмечено существенной отрицательной динамики биохимических показателей. Авторы также представили анализ 25 спонтанных сообщений о случаях развития серьезной гепатопатии у больных, получавших терапевтические дозы парацетамола – от 1 до 4 г/сут., на протяжении от 1 до 90 дней. Все пациенты либо злоупотребляли алкоголем, либо изначально имели серьезную патологию печени. По мнению авторов, лишь 5 эпизодов гепатотоксических осложнений действительно можно считать связанными с приемом парацетамола. При этом точную дозу этого препарата, использованную пострадавшим, определить весьма затруднительно, т.е. речь может идти о возможности несознательной передозировки. Во всех других случаях имелся факт приема других гепатотоксичных препаратов, а также нельзя было исключить прогрессирование основного заболевания печени [70]. В то же время нельзя не отметить, что в единичных эпидемиологических исследованиях была отмечена ассоциация между приемом парацетамола и развитием нарушений функции почек. Так, в известном эпидемиологическом исследовании, проведенном в США и касающемся здоровья женщин (NHS), у 1697 участниц было прослежено снижение клубочковой фильтрации за 11–летний период наблюдения. Регулярный прием высоких доз парацетамола – суммарно более 3000 г (3 кг!) за период наблюдения, ассоциировался с 2–кратным повышением риска значимого снижения функции почек, в сравнении с лицами, получавшими меньшие дозы этого препарата или не получавшими анальгетиков (ОР 2,04: 1,28–3,24) [71]. Разумеется, при трактовке подобных эпидемиологических работ следует учитывать указанные нами выше принципиальные ограничения. Любопытно, что оценка влияния различных обезболивающих препаратов на развитие почечной патологии у мужчин показала совершенно другие результаты. Авторы масштабного популяционного исследования изучали значимое повышение уровня креатинина и снижение клиренса креатинина у 11 032 мужчин за 14–летний период наблюдения. Среди людей, регулярно использовавших парацетамол – в среднем более 2500 доз за весь период, риск развития патологии почек оказался более низким: ОР 0,83 (0,50–1,39). Он оказался даже несколько ниже, в сравнении с регулярным приемом АСК 0,98 (0,53–1,81) и других НПВП – 1,07 (0,71–1,64) [72]. Есть достаточно убедительные данные, что длительное применение парацетамола в максимальной суточной дозе не приводит к существенному возрастанию частоты гепаторенальных осложнений. Это показали результаты крупного исследования, в котором изучалась частота данной патологии у 7781 пациентов с ревматическими заболеваниями, 24% из которых получали парацетамол 3 г/сут., а 76% 4 г/сут. в среднем на протяжении более полугода. Осложнения со стороны печени и почек были отмечены лишь у 0,86 и 0,68% больных соответственно. Таким образом, на фоне приема более высокой дозы осложнения возникали даже реже, чем при использовании более низкой дозы [73]. Большой интерес представляют данные относительно применения парацетамола у больных, уже имеющих серьезную ренальную патологию. Изучению этого вопроса было посвящено исследование шведских ученых Evans M. и сотр., которые изучили влияние этого препарата, а также АСК, на развитие признаков почечной недостаточности у 801 больного с диагностированными заболеваниями почек. Среди этих лиц исходный уровень креатинина составлял >3,4 мг/дл у мужчин и >2,8 мг/дл у женщин. Предметом анализа стали темпы снижения клубочковой фильтрации за период от 5 до 7 лет. У больных, регулярно использовавших парацетамол, снижение уровня клубочковой фильтрации за год в среднем составляло 0,93 мл/мин. Среди принимавших АСК были отмечены аналогичные результаты. Удивительно, но среди лиц, не получавших регулярно каких–либо анальгетиков, отмечалось ускоренное снижение уровня клубочковой фильтрации [74].
Заключение
Парацетамол – достаточно эффективный, недорогой, удобный в использовании безрецептурный анальгетик, обладающий превосходной переносимостью. Эти качества позволяют рассматривать парацетамол как средство «первой линии» при умеренно выраженной боли самого различного происхождения. Несомненно, российским врачам необходимо более активно использовать этот препарат в своей клинической работе.
Принципиальным отличием парацетамола от НПВП является его относительная безопасность: он гораздо реже вызывает осложнения со стороны ЖКТ и сердечно–сосудистой системы. Это позволяет использовать парацетамол у больных с серьезными факторами риска лекарственных осложнений, когда применение НПВП может приводить к серьезным проблемам. Важнейшая область использования парацетамола – купирование боли у пожилых больных, страдающих ОА и имеющих множественные коморбидные заболевания. У данной категории пациентов лечение следует начинать именно с парацетамола (особенно если нет признаков вторичного синовита, а боль носит умеренный характер), а переходить к использованию НПВП лишь в том случае, если боль не удается купировать.
Сочетанное применение парацетамола с НПВП и трамадолом существенно повышает их эффективность. К тому же такая комбинация позволяет уменьшить среднюю суточную дозу НПВП, что может быть важным фактором снижения риска класс–специфических побочных эффектов этого класса анальгетиков.
При использовании терапевтических доз парацетамола (до 4 г/сут.) вероятность развития серьезных побочных эффектов со стороны печени и почек представляется достаточно низкой. Даже у больных с циррозом печени и алкоголизмом, по данным ряда серьезных клинических исследований (вопреки распространенному в России мнению), парацетамол переносится достаточно хорошо и не вызывает опасных осложнений. Аналогичная ситуация отмечается и при использовании парацетамола у больных с почечной патологией. Конечно, у больных с серьезными коморбидными заболеваниями любая анальгетическая терапия должна проводиться с большой осторожностью – однако в плане безопасности парацетамол представляется в этой ситуации несомненным препаратом выбора.
![Рис. 2. Рекомендации американской ассоциации кардиологов (АНА) по лечению боли при заболеваниях опорно-двигательной системы при наличии кардиологической патологии: на первом месте по безопасности – парацетамол [60]](http://www.rmj.ru/data/articles/Image/t18/n25/1477-3.gif)

Литература
1. Насонов Е.Л. Нестероидные противоспалительные препараты (Перспективы применения в медицине). Москва, Издательство «Анко», 2000; 142 с.
2. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, «ИМА–ПРЕСС», 2009, 167 с.
3. Day R., Graham G., Whelton A. The position of paracetamol in the world of analgesics. Am. J. Therap., 2000, 7, 51–55
4. Prescott L. Paracetamol: past, present and future. Am. J. Therap., 2000, 7, 135–143
5. Fries J., Kristen N., Bennet M., et al. The rise and decline of nonsteroidal anti–inflammatory drag–associated gastropathy in rheumatoid arthritis. Arthritis Rheum 2004; 50:2433–2440.
6. Сороцкая В.Н., Каратеев А.Е. Желудочно–кишечные осложнения как одна из причин смерти больных ревматическими заболеваниями. Научно–практическая ревматология 2005; 4: 34–38.
7. Lain L. Proton pump inhibitor co–therapy with nonsteroidal anti–inflammatory drugs – nice or necessary? Rew Gastroenterol Dis, 2004; 4: 33–41.
8. Hochman J., Shah N. What Price Pain Relief? Circulation. 2006; 113: 2868–2870.
9. Hermann M. Cardiovascular risk associated with nonsteroidal anti–inflammatory drugs. Curr. Rheumatol Rep. 2009, 11(1): 31–35.
10. Aw T–J., Haas S., Liew D. Meta–analysis of cyclooxygenase–2 inhibitors and their effects on blood pressure. Arch Intern Med 2005; 165: 490–496
11. Wang P., Avorn J., Brookhart M., et al. Effects of noncardiovascular comorbidities on anti–hypertensive use in elderly hypertensives. Hypertension. 2005, 46(2): 273–279.
12. Lanas A., Tornero J., Zamorano J. Assessment of gastrointestinal and cardiovascular risk in patients with osteoarthritis who require NSAIDs: the LOGICA study. Ann Rheum Dis. 2010, 69(8):1453–1458.
13. Blot W., McLaughlin J. Over the counter non–steroidal anti–inflammatory drugs and risk of gastrointestinal bleeding. J Epidemiol Biostat. 2000; 5(2): 137–42.
14. Delemos B., Xiang J., Benson C., et al. Tramadol Hydrochloride Extended–Release Once–Daily in the Treatment of Osteoarthritis of the Knee and/or Hip: A Double–Blind, Randomized, Dose–Ranging Trial. Am J Ther. 2010 Mar 3. [Epub ahead of print]
15. Kalso E., Simpson H.,Slappendel R., et al. Predicting long–term response to strong opioids in patients with low back pain: findings from a randomized, controlled trial of transdermal fentanyl and morphine. BMC Med. 2007; 5: 39.
16. Cepeda M., Camargo F., Zea C., Valencia L. Tramadol for osteoarthritis: a systematic review and metaanalysis. J Rheumatol. 2007,34(3): 543–55.
17. Nuesch E., Rutjes A., Husni E., Welch V., Juni P. Oral or transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst Rev. 2009, 7;(4):CD003115.
18. Smith H. Potential Analgesic Mechanisms of Acetaminophen. Pain Physician 2009; 12: 269–280
19. Hinz B., Cheremina O., Brune K. Acetaminophen (paracetamol) is a selective cyclooxygenase–2 inhibitor in man. FASEB J. 2008 Feb;22(2):383–390.
20. McDaid C., Maund E., Rice S., et al. Paracetamol and selective and non–1 selective non–steroidal anti–inflammatory drugs (NSAIDs) for the reduction of morphine–related side effects after major surgery: a systematic review. Health Technology Assessment, 2010, 14 (17)
21. Toms L., McQuay H., Derry S., Moore R. Single dose oral paracetamol (acetaminophen) for postoperative pain in adults. Cochrane Database Syst Rev. 2008,8;(4):CD004602.
22. Weyant R. Paracetamol (acetaminophen) is safe and effective for treatment of postoperative third molar extraction pain. J Evid Based Dent Pract. 2009, 9(4): 211–212.
23. Dodson T. Paracetamol is an effective drug to use for pain following oral surgery. Evid Based Dent. 2007; 8(3):79–80.
24. Cuvellier J., Donnet A., Guegan–Massardier E., et al. Treatment of primary headache in children: a multicenter hospital–based study in France. J Headache Pain. 2009, 10(6):447–453.
25. Prior M., Codispoti J., Fu M. A Randomized, Placebo–Controlled Trial of Acetaminophen for Treatment of Migraine Headache. Headache. 2010 Mar 5. [Epub ahead of print]
26. Pfaffenrath V., Diener H., Pageler L. et al. OTC analgesics in headache treatment: open–label phase vs randomized double–blind phase of a large clinical trial. Headache. 2009, 49(5):638–645.
27. Bachert C., Chuchalin A., Eisebitt R., et al. Aspirin compared with acetaminophen in the treatment of fever and other symptoms of upper respiratory tract infection in adults: a multicenter, randomized, double–blind, double–dummy, placebo–controlled, parallel–group, single–dose, 6–hour dose–ranging study. Clin Ther. 2005, 27(7): 993–1003.
28. Dougados M. Why and how to use NSAIDs in osteoarthritis. J Cardiovasc Pharmacol. 2006; 47 Suppl 1: 49–54.
29. Pavelka K. Symptomatic treatment of osteoarthritis: paracetamol or NSAIDs? Int J Clin Pract Suppl. 2004, 144: 5–12.
30. Ревматология. Национальное руководство. Под ред. Насонова Е.Л., Насоновой В.А. Москва, «ГЭОТАР–Медиа», 2008; 720 с.
31. Zhang W., Doherty M., Arden N., et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2005, 64(4):655–666.
32. Jordan K., Arden N., Doherty M., et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis. 2003, 62(12): 1145–1155.
33. Denoeud L., Mazieres B., Payen–Champenois C., Ravaud P. First line treatment of knee osteoarthritis in outpatients in France: adherence to the EULAR 2000 recommendations and factors influencing adherence. Ann Rheum Dis., 2005, 64, 70–74
34. Schnitzer T., Weaver A., Polis A. Efficacy of rofecoxib, celecoxib, and acetaminophen in patients with osteoarthritis of the knee. A combined analysis of the VACT studies. J. Rheumatol., 2005, 32, 1093–1105.
35. Pincus T., Koch G., Lei H., et al. Patient Preference for Placebo, Acetaminophen (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patients with knee or hip osteoarthritis. Ann. Rheum. Dis., 2004, 63, 931–939.
36. Boureau F., Schneid H., Zeghari N., et al. The IPSO study: ibuprofen, paracetamol study in osteoarthritis. A randomised comparative clinical study comparing the efficacy and safety of ibuprofen and paracetamol analgesic treatment of osteoarthritis of knee or hip. Ann. Rheum. Dis., 2004, 63, 1028–1035.
37. Williams H., Ward J., Egger M., et al. Comparison of naproxen and acetaminophen in a two–year study of treatment of osteoarthritis of the knee. Arthritis Rheum. 1993 Sep;36(9):1196–206.
38. Temple A., Benson G., Zinsenheim J., Schweinle J. Multicenter, randomized, double–blind, active–controlled, parallel–group trial of the long–term (6–12 months) safety of acetaminophen in adult patients with osteoarthritis. Clin Ther. 2006, 28(2):222–235.
39. Towheed T., Maxwell L., Judd M., et al. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev., 2006, 25;(1):CD004257.
40. Toms L., Derry S., Moore R., McQuay H. Single dose oral paracetamol (acetaminophen) with codeine for postoperative pain in adults. Cochrane Database Syst Rev. 2009; 21;(1):CD001547.
41. McQuay H., Edwards J. Meta–analysis of single dose oral tramadol plus acetaminophen in acute postoperative pain. Eur J Anaesthesiol Suppl. 2003; 28: 19–22.
42. Fricke J., Hewitt D., Jordan D., et al. A double–blind placebo–controlled comparison of tramadol/acetaminophen and tramadol in patients with postoperative dental pain. Pain. 2004, 109(3):250–257
43. Ong C., Seymour R., Lirk P, Merry A. Combining paracetamol (acetaminophen) with nonsteroidal antiinflammatory drugs: a qualitative systematic review of analgesic efficacy for acute postoperative pain. Anesth Analg. 2010,110(4): 1170–1179.
44. Akural E., Jarvimaki V. Lansineva A., et al. Effects of combination treatment with ketoprofen 100 mg + acetaminophen 1000 mg on postoperative dental pain: a single–dose, 10–hour, randomized, double–blind, active– and placebo–controlled clinical trial. Clin Ther. 2009,31(3):560–568.
45. Altman R. A rationale for combining acetaminophen and NSAIDs for mild–to–moderate pain. Clin Exp Rheumatol. 2004, 22(1):110–117.
46. Graham G., Scott K., Day R. Tolerability of paracetamol. Drug Saf. 2005;28(3):227–40.
47. Andrade S., Martinez C., Walker A. Comparative safety evaluation of non–narcotic analgesics. J Clin Epidemiol. 1998, 51(12): 1357–1365.
48. Singh G. Gastrointestinal complication of prescription and over–the–counter nonsteroidal anti–inflammatory drugs: a view from the ARAMIS database. Am J Ther., 2000, 7, 115–121.
49. Lanza F., Codispoti J., Nelson E. An endoscopic comparison of gastroduodenal injury with over–the–counter doses of ketoprofen and acetaminophen. Am J Gastroenterol. 1998, 93(7), 1051–1054.
50. Lanas A., Garcia–Rodriguez L., Arroyo M., et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo–oxygenase–2 inhibitors, traditional non–aspirin non–steroidal anti–inflammatory drugs, aspirin and combinations. Gut. 2006, 55 (12):1731–1738.
51. Rahme E., Barkun A., Nedjar H., et al. Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the elderly in Quebec, Canada. Am J Gastroenterol. 2008 Apr;103(4):872–82.
52. Garcia Rodriguez L., Hernandez–Diaz S. Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti–inflammatory drugs. Epidemiology. 2001, 12(5):570–576.
53. Hale S., Kloner R. Acetaminophen and experimental acute myocardial infarction. Cardiovasc Drugs Ther. 2004, 18(2): 121–125.
54. Leshnower B., Sakamoto H., Zeeshan A., et al. Role of acetaminophen in acute myocardial infarction. Am J Physiol Heart Circ Physiol. 2006, 290(6): 2424–2431.
55. Galliard–Grigioni K., Reinhart W. A randomized, controlled study on the influence of acetaminophen, diclofenac, or naproxen on aspirin–induced inhibition of platelet aggregation. Eur J Pharmacol. 2009, 609(1–3):96–99.
56. Chan A., Manson J., Albert C., et al. Nonsteroidal antiinflammatory drugs, acetaminophen, and the risk of cardiovascular events. Circulation. 2006, 28; 113(12): 1578–87.
57. Dedier J., Stampfer M., Hankinson S., et al. Nonnarcotic analgesic use and the risk of hypertension in US women. Hypertension. 2002, 40(5): 604–608.
58. Forman J., Rimm E., Curhan G. Frequency of analgesic use and risk of hypertension among men. Arch Intern Med. 2007, 26;167(4): 394–399.
59. Алексеева Л.И., Каратеев А.Е., Попкова Т.В. и др. Эффективность и безопасность длительного применения нимесулида у больных остеоартрозом: результаты 12–ти месячного открытого контролируемого исследования ДИНАМО (Длительное Использование Нимесулида при Артрозе Многофакторная Оценка). Научно–практическая ревматология, 2009, 4, 64–72.
60. Antman E., Bennett J., Daugherty A., et al. Use of Nonsteroidal Antiinflammatory Drugs. An Update for Clinicians: A Scientific Statement From the American Heart Association. Circulation. 2007; 115: 1634–1642.
61. Dippel D., van Breda E., van der Worp H., et al. Effect of paracetamol (acetaminophen) and ibuprofen on body temperature in acute ischemic stroke PISA, a phase II double–blind, randomized, placebo–controlled trial [ISRCTN98608690]. BMC Cardiovasc Disord. 2003; 3: 2
62. den Hertog H., van der Worp H., van Gemert H., et al. The Paracetamol (Acetaminophen) In Stroke (PAIS) trial: a multicentre, randomised, placebo–controlled, phase III trial. Lancet Neurol. 2009, 8(5):434–40.
63. Latimer N., Lord J., Grant R., et al. Cost effectiveness of COX 2 selective inhibitors and traditional NSAIDs alone or in combination with a proton pump inhibitor for people with osteoarthritis. BMJ. 2009, 14; 339: 25 – 38.
64. Zyoud S., Awang R., Sulaiman S., Al–Jabi S. Association between gastrointestinal manifestations following acetaminophen poisoning and outcome in 291 acetaminophen poisoning patients. Pharmacoepidemiol Drug Saf. 2010,19(5): 511–517.
65. Dart R., Erdman A., Olson K., et al. Acetaminophen poisoning: an evidence–based consensus guideline for out–of–hospital management. Clin Toxicol (Phila). 2006; 44(1):1–18.
66. Larson A., Polson J., Fontana R. et al. Acetaminophen–induced acute liver failure: results of a United States multicenter, prospective study. Hepatology. 2005, 42(6): 1364 –1372.
67. Mazer M., Perrone J. Acetaminophen–induced nephrotoxicity: pathophysiology, clinical manifestations, and management. J Med Toxicol. 2008, 4(1): 2–6.
68. Herrero J., Castellano I., Gomez–Martino J., et al. Acute kidney failure caused by paracetamol poisoning. Nefrologia. 2001;21(6):592–595.
69. Kuffner E., Temple A., Cooper K. et al. Retrospective analysis of transient elevations in alanine aminotransferase during long–term treatment with acetaminophen in osteoarthritis clinical trials. Curr Med Res Opin. 2006, 22(11): 2137–2148.
70. Dart R., Kuffner E., Rumack B. Treatment of pain or fever with paracetamol (acetaminophen) in the aloholic patient: a systematic review. Am J Ther., 2000, 7, 123–134.
71. Curhan G., Knight E., Rosner B., et al. Lifetime nonnarcotic analgesic use and decline in renal function in women. Arch Intern Med. 2004, 26; 164(14): 1519–1524.
72. Rexrode K., Buring J., Glynn R., et al. Analgesic use and renal function in men. JAMA. 2001, 18; 286(3): 315–321.
73. Ganry H., Pruvot F., Vesque D., Schmidely N. Liver and renal tolerance to paracetamol: 3 g or 4 g per day? Presse Med. 2001,21;30(15):724–730.
74. Evans M., Fored C., Bellocco R., et al. Acetaminophen, aspirin and progression of advanced chronic kidney disease. Nephrol Dial Transplant. 2009; 24(6): 1908–1918.
Каратеев А.Е.
РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: 









