
По определению рекомендаций Российского общества ангиологов и сосудистых хирургов, критическая ишемия нижних конечностей – это проявление заболеваний периферических артерий, включающее больных с типичными хроническими болями покоя (преимущественно в ночное время суток), с ишемическими трофическими расстройствами, как язвами, так и гангреной, и с перемежающейся хромотой менее 30 м. Термин «критическая ишемия»; используется в случае наличия симптоматики в течение больше 2 нед. По классификации Фонтейна – Покровского, это состояние соответствует III–IV стадиям заболевания периферических артерий. Плохой прогноз течения этого заболевания связан с высоким риском ампутации конечности или развитием фатального или нефатального сосудистого события. В литературе прогноз этого заболевания сравнивается с прогнозом больных со злокачественными новообразованиями. Около 25% пациентов с таким диагнозом умирают, и у 30% требуется высокая ампутация конечности в течение года от момента начала заболевания [3,4]. Целями лечения критической ишемии нижних конечностей являются купирование ишемических болей, заживление ишемических язв, повышение активности пациента, улучшение качества его жизни и отдаленный прогноз с первичным исходом – выживаемостью без ампутаций. Необходимой мерой для достижения этих целей является реваскуляризация. Возможность ее проведения зависит от уровня, степени и протяженности поражения артерии. Прямая реваскуляризация проводится при ограниченных поражениях артерий, при сохранном дистальном русле. В случае полисегментарных артериальных поражений или если операция была проведена, но явления ишемии по каким–либо причинам нарастают, больным проводятся непрямые реваскуляризирующие операции [5]. Существует мнение, что оперативное лечение, выполняемое у больных с критической ишемией нижних конечностей, не влияет на этиологию и патогенетическую сущность атеросклеротического процесса и тем самым лишь обеспечивает выигрыш времени для развития коллатералей и адаптации микроциркуляторного русла [1,2]. Основными направлениями консервативного лечения принято считать улучшение реологических свойств крови, повышение антиоксидантной активности крови, подавление гиперпродукции компонентов воспаления, иммунокоррекцию, нормализацию липидного обмена, стимуляцию развития коллатералей [2,6]. В настоящее время существует несколько терапевтических подходов к лечению больных с хроническими облитерирующими заболеваниями нижних конечностей, каждое из которых имеет свои преимущества и недостатки. Поиск оптимального метода консервативного ведения больных с хронической критической ишемией нижних конечностей остается до сих пор важной и не до конца решенной задачей. В нашем исследовании был применен препарат Актовегин, положительное действие которого доказано при ангиопатиях различного генеза [6,7]. Актовегин представляет собой депротеинизированный гемодериват, получаемый из крови телят методом ультрафильтрации. Препарат содержит низкомолекулярные соединения массой до 5000 Да. Актовегин стимулирует потребление и поглощение кислорода, а также клеточный энергетический метаболизм. Препарат оказывает инсулиноподобное действие, стимулируя транспорт глюкозы, пируватдегидрогеназу и окисление глюкозы. Указанные свойства препарата позволяют предположить, что введение Актовегина в терапевтических дозах позволит улучшить течение хронической критической ишемии нижних конечностей у больных с нереконструируемым поражением артериального русла путем уменьшения степени тканевой ишемии [7]. На этом основании проведено исследование для оценки эффективности и безопасности лечения Актовегином проведением инфузий Актовегина (2000 мг) 1 раз/сут. в течение 14 дней. Схема и методы исследования. Данное исследование проводилось отделом хирургии сосудов НИЦ ММА имени И.М. Сеченова на базе второго ангиохирургического отделения ЦКБ №2 им. Н.А. Семашко, руководитель отдела профессор Г.С. Кротовский, заведующий отделением д.м.н. И.Г. Учкин. Все методы инструментального и лабораторного обследований проводились на указанной базе. В исследование были включены пациенты с нереконструируемыми поражениями артериального русла нижних конечностей с клинической картиной хронического облитерирующего заболевания артерий нижних конечностей, соответствующего III–IV стадиям по классификации Фонтейна – Покровского. Критерием отбора больных для исследования стало наличие «боли покоя» как клиническое проявление данного заболевания. Количество пациентов, вошедших в данное исследование, составило 58 человек, средний возраст 62 года ± 7 лет. Причинами хронического окклюзионного поражения артериального русла нижних конечностей у данной группы больных явился облитерирующий атеросклероз. Продолжительность заболевания колебалась от нескольких месяцев до 7 лет, большинство 2–4 года, в среднем 3,0±0,5 года. Степень операбельности артериального русла нижних конечностей с точки зрения возможности проведения реваскуляризирующих операций определялась на основании данных ультразвукового дуплексного сканирования и рентгеноконтрастной ангиографии. 52 пациента (89,7%) перенесли в анамнезе прямые открытые и/или эндоваскулярные реваскуляризирующие операции. 45 пациентов (77,6%) в анамнезе перенесли непрямые реваскуляризирующие операции (реваскуляризирующая остеотрепанация и/или поясничная симпатоэктомия). Основными критериями неоперабельности артериального русла являлись наличие протяженной окклюзии артериального русла с переходом на дистальные артериальные участки артерий конечности, «многоэтажное» поражение артериальной системы. У 10 пациентов (31%) имелись трофические дефекты (хроническая артериальная язва до 2–3 см в максимальном поперечнике), длительностью в среднем от 1 до 7 мес. Из сопутствующих заболеваний у 17 (29,3%) больных имелся сахарный диабет 2–го типа в стадии компенсации, у 43 (73,6%) больных имелась ИБС, стенокардия напряжения II–III функционального класса, у 41 (70,7%) – артериальная гипертензия. У 20% больных отмечена сердечная недостаточность различной степени тяжести. Всем пациентам в течение 5 мес. перед проведением исследования была выполнена Rо–контрастная ангиография артерий нижних конечностей. В течение месяца до проведения исследования всем больным был проведен курс стандартной инфузионной терапии 10 внутривенных вливаний раствора реополиглюкина 200 мл с раствором пентоксифиллина 5,0 мл. На момент проведения исследования боли покоя были купированы у всех пациентов. Группу исследования I составили 30 пациентов. Лечение состояло из 14 внутривенных инфузий, проводимых 1 раз/сут. (20% Актовегин с концентрацией 8 мг/мл, скорость инфузии 2 мл/мин). В группу исследования II вошли 28 пациентов, которым проводилось 14 внутривенных введений 250 мл 0,9% натрия хлорида. Все флаконы, содержащие раствор для инфузии (активный или плацебо), были идентичными и закрывались непрозрачными пластиковыми крышками, в то время как трубки для инфузий были произведены из цветного пластмассового материала. Растворы проверяли визуально на наличие инородных тел. Пациентам проводилось обследование до исследования и в последний день после него. Осложнений, связанных с применением Актовегина, выявлено не было. 25 человек (83% от общего количества в группе I) после лечения субъективно отмечали уменьшение жжения и потепление конечности, появление «легкости» в ногах. При наличии многоэтажного поражения магистрального русла клинического эффекта от проведенного лечения не наблюдалось: у всех больных, не отмечавших клинического улучшения, было сочетанное многоуровневое поражение артерий, IIIб и IV стадии артериальной недостаточности конечности. Рецидива ночных болей и болей покоя отмечено не было. После курса терапии Актовегином по данным дуплексного сканирования определилось достоверное улучшение гемодинамики конечностей: прирост (
?) среднегруппового значения PSV в ОБА составил 9,2%, в ГБА 7,9%, в ПБА 13,4%, в ПА 19,8%, в ЗББА 36,9%, в ПББА 31,3%. Прирост (
?) среднегруппового значения TAM в ОБА 9,6%, в ГБА 9,7%, в ПБА 13,1%, в ПА 19,9%, в ЗББА 37,8%, в ПББА 33%. Прирост (
?) среднегруппового значения MDV в ОБА составил 10,2%, в ГБА 11,1%, в ПБА 12,9%, в ПА 20%, в ЗББА 39,1%, в ПББА 34,9%. Величина прироста (
?) среднегруппового значения VF в ОБА составила 12,3%, в ГБА 8,9%, в ПБА 12,4%, в ПА 20,1%; величина VF в ЗББА возросла на 30%, в ПББА на 36% (рис. 1). Побочных явлений при внутривенном введении Актовегина не отмечалось ни в одном случае. 28 пациентов, включенных в II группу, были исследованы в 1–е сутки после окончания курса введения плацебо. У 20 пациентов (71,4% от общего количества в группе) клинической динамики от проведенной терапии не отмечалось. У 5 пациентов (17,9%) возобновились ночные боли покоя, что потребовало обезболивания и назначения дополнительного лечения. У пациентов II группы после курса введения плацебо не было выявлено статистически значимого изменения диаметра, площади поперечного сечения, а также качественных и количественных параметров допплеровского спектра во всех артериях исследуемой конечности. Физическое функционирование по SF–36 улучшилось после введения 14 инфузий Актовегина. По остальным параметрам опросника достоверных различий получено не было. Выводы. Результаты данного исследования указывают на то, что лечение проведением инфузий Актовегина (2000 мг) 1 раз/сут. курсом 14 дней уменьшает выраженность проявления симптомов критической ишемии нижних конечностей. Данные выводы можно сделать на основании субъективных ощущений пациентов основной группы исследования после проведения курса терапии. Прирост гемодинамических показателей, по данным ультразвукового дуплексного сканирования, служит тому инструментальным подтверждением. Отсутствие побочных явлений в обеих группах демонстрирует безопасность его применения у пациентов с хронической артериальной недостаточностью. Макет данного исследования был построен таким образом, что пациентам проводился курс лечения Актовегином после проведения базисной стандартной терапии с условием купированных ночных болей покоя ишемического генеза. Полученные результаты указывают на возможность проведения рандомизированного исследования, направленного на изучение возможностей действия Актовегина в качестве компонента стандартных методов лечения пациентов с хронической ишемией нижних конечностей с нереконструируемым поражением артериального русла. 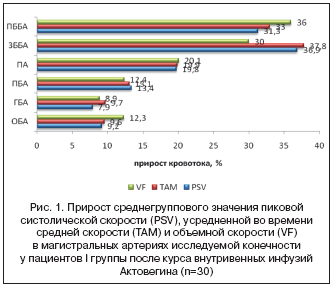 Литература 1. Савельев В.С., Кошкин В.М., Каралкин А.В., Тарковский А.А. Критическая ишемия нижних конечностей: определение понятия и гемодинамическая характеристика. Ангиология и сосудистая хирургия. 1996; 3: 84–90. 2. Кротовский Г.С., Зудин А.М. Тактика лечения пациентов с критической ишемией нижних конечностей. М:. 2005; 160. 3. Рекомендации Российского общества ангиологов и сосудистых хирургов «Диагностика и лечение больных с заболеваниями периферических артерий». М:. 2007; 112. 4. Российский консенсус «Диагностика и лечение пациентов с критической ишемией нижних конечностей». М:. 2002; 40. 5. TransAtlantic Inter–Society Consensus (TASC) on Management of Peripheral Arterial Disease (PAD). J. Vasc. Surg. 2000; 31: 1–296. 6. Кошкин В.М., Богданец Л.И., Родионов С.В., Хаев С.Х. Об эффективности комплексной консервативной терапии больных хроническими облитерирующими заболеваниями в амбулаторной практике. Грудная и сердечно–сосудистая хирургия. 1993; 3: 9–11. 7. Dan Ziegler, Lusine Movsesyan, Boris Mankovsky, Irina Gurieva, Zhangentkhan Abylaiuly, and Igor Strokov Treatment of Symptomatic Polyneuropathy With Actovegin in Type 2 Diabetic Patients. Diabetes Care August 2009 32:1479–1484. РМЖ
Литература 1. Савельев В.С., Кошкин В.М., Каралкин А.В., Тарковский А.А. Критическая ишемия нижних конечностей: определение понятия и гемодинамическая характеристика. Ангиология и сосудистая хирургия. 1996; 3: 84–90. 2. Кротовский Г.С., Зудин А.М. Тактика лечения пациентов с критической ишемией нижних конечностей. М:. 2005; 160. 3. Рекомендации Российского общества ангиологов и сосудистых хирургов «Диагностика и лечение больных с заболеваниями периферических артерий». М:. 2007; 112. 4. Российский консенсус «Диагностика и лечение пациентов с критической ишемией нижних конечностей». М:. 2002; 40. 5. TransAtlantic Inter–Society Consensus (TASC) on Management of Peripheral Arterial Disease (PAD). J. Vasc. Surg. 2000; 31: 1–296. 6. Кошкин В.М., Богданец Л.И., Родионов С.В., Хаев С.Х. Об эффективности комплексной консервативной терапии больных хроническими облитерирующими заболеваниями в амбулаторной практике. Грудная и сердечно–сосудистая хирургия. 1993; 3: 9–11. 7. Dan Ziegler, Lusine Movsesyan, Boris Mankovsky, Irina Gurieva, Zhangentkhan Abylaiuly, and Igor Strokov Treatment of Symptomatic Polyneuropathy With Actovegin in Type 2 Diabetic Patients. Diabetes Care August 2009 32:1479–1484. РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки:
У нас в лечебно-диагностическом центре каких либо негативных реакций на прием Актовегина не выявлено за несколько лет применения…